Arbeitsgruppe Schlee
Arbeitsgruppenleiter
Prof. Dr. rer. nat. Martin Schlee
Enable JavaScript to view protected content.
Tel.: +49 228 287-16080
Fax: +49 228 287-16094
Forschungsschwerpunkt unserer Arbeitsgruppe ist die antivirale Immunantwort des angeborenen Immunsystems. Hier initiieren und steuern hauptsächlich Nukleinsäure-Rezeptoren die antivirale Immunantwort des infizierten Organismus. Nukleinsäure-Rezeptoren erkennen DNA und RNA eindringender Pathogene anhand ungewöhnlicher Lokalisierung, Struktur und Modifikationen (Abb.1). Eine besondere Herausforderung ist hier, dass das angeborene Immunsystem zwar sensitiv pathogene Nukleinsäuren erkennt, ohne dabei jedoch durch die endogenen Nukleinsäuren aktiviert zu werden. Während eine zu schwache Immunerkennung die Ausbreitung von Infektionen begünstigt, führt eine überschießende Immunerkennung von Nukleinsäuren zu Autoimmunerkrankungen wie Lupus erythematodes (insbesondere des Typs Aicardi-Goutières syndrome (AGS)). Unser Labor arbeitet dabei insbesondere an Strukturen und Modifikationen, die zur Erkennung durch Nukleinsäurerezeptoren führen oder die Erkennung verhindern. Bisher haben wir uns auf die zytosolischen Rezeptoren RIG-I und cGAS konzentriert. Hier haben wir Nukleinsäure-Erkennungsmotive für RIG-I und cGAS beschrieben (Schlee et al., 2009; Goubau et al., 2014; Herzner et al., 2015) und einen Immuntoleranz-Mechanismus von endogenen RNAs gegenüber RIG-I durch Cap-Methylierung entdeckt (Schuberth-Wagner et al., 2015). Der RNA-Rezeptor RIG-I ist für die antivirale Immunantwort gegen die meisten RNA-Viren, wie z.B. INFLUENZA-, Hanta-, Masern-Virus und Ebola-Virus etc. essentiell. Nach Stimulation induziert RIG-I eine IFN-a/b- dominierte Signalkaskade, die antivirale Programme der Zelle induziert. cGAS erkennt virale oder endogene doppelsträngige DNA (dsDNA) und induziert ebenfalls eine IFN-a/b dominierte Signalkaskade. Während RIG-I vor allem ungewöhnliche Modifikationen am 5’Ende von doppelsträngiger RNA erkennt (Schlee et al., 2009), wird cGAS von langer doppelsträngiger DNA (dsDNA) oder durch kurze dsDNA mit G-reichen Überhängen stimuliert (Herzner et al., 2015). Die Identifikation von minimalen Nukleinsäure-Erkennungsmotiven kann genutzt werden, um Medikamente zur Immuntherapie von viralen Infektionen und Krebs zu entwickeln. Auf Basis eines in unserem Labor entwickelten RIG-I-Liganden wurde in Bonn die Firma RIGONTEC (mittlerweile MSD) gegründet.
Aktuell forschen wir neben den oben genannten Themen an Effekten von RNA-Modifikationen auf Immunerkennung, Splicing und Translation.
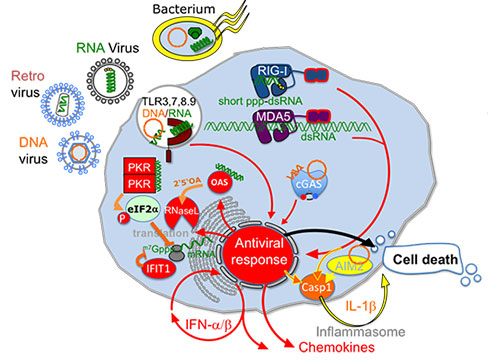
Abbildung 1: Erkennung eindringender Pathogene durch Nukleinsäurerezeptoren
Das angeborene Immunsystem erkennt eindringende Viren und manche Bakterien durch Detektion des genetischen Materials anhand ungewöhnlicher Lokalisierung, Struktur oder Modifikation. TLR3, 7 und 8 erkennen RNA, TLR9 erkennt DNA im Endosom, RIG-I und MDA5 detektieren pathogene RNA und cGAS erkennt DNA im Zytosol. Die Stimulation der genannten Nukleinsäurerezeptoren führt zur Induktion einer IFN-a/b-dominierten Immunantwort. IFN-a/b induziert die Expression von antiviralen Effektorproteinen, die ebenfalls ungewöhnliche Strukturen oder Modifikationen detektieren und z.B. RNA-Translation inhibieren (PKR, IFIT1) oder RNA degradieren (RNaseL).
de Regt AK, Anand K, Ciupka K, Bender F, Gatterdam K, Putschli B, Fusshöller D, Hilbig D, Kirchhoff A, Hunkler C, Wolter S, Grünewald A, Wallerath C, Schuberth-Wagner C, Ludwig J, Paeschke K, Bartok E, Hagelueken G, Hartmann G, Zillinger T, Geyer M, Schlee M. A conserved isoleucine in the binding pocket of RIG-I controls immune tolerance to mitochondrial RNA. Nucleic Acids Res. 2023. gkad835. https://pubmed.ncbi.nlm.nih.gov/37831086/
Mohamed AA, Soler S, Wegner J, Bartok E, Stankovic S, Brooks AG, Schlee M. Influenza A Infection Stimulates RIG-I and Enhances Effector Function of Primary Human NK Cells.Int J Mol Sci. 2023 Jul 30;24(15):12220. https://pubmed.ncbi.nlm.nih.gov/37569596/
Wegner J, Hunkler C, Ciupka K, Hartmann G, Schlee M. Increased IKKϵ protein stability ensures efficient type I interferon responses in conditions of TBK1 deficiency.Front Immunol. 2023;14:1073608. https://pubmed.ncbi.nlm.nih.gov/36936901/
Brägelmann J, Lorenz C, Borchmann S, Nishii K, Wegner J, Meder L, Ostendorp J, Ast DF, Heimsoeth A, Nakasuka T, Hirabae A, Okawa S, Dammert MA, Plenker D, Klein S, Lohneis P, Gu J, Godfrey LK, Forster J, Trajkovic-Arsic M, Zillinger T, Haarmann M, Quaas A, Lennartz S, Schmiel M, D'Rozario J, Thomas ES, Li H, Schmitt CA, George J, Thomas RK, von Karstedt S, Hartmann G, Büttner R, Ullrich RT, Siveke JT, Ohashi K, Schlee M, Sos ML. MAPK-pathway inhibition mediates inflammatory reprogramming and sensitizes tumors to targeted activation of innate immunity sensor RIG-I. Nat Commun. 2021 Sep 17;12(1):5505.https://pubmed.ncbi.nlm.nih.gov/34535668/
Wegner J, Zillinger T, Schlee-Guimaraes TM, Bartok E, Schlee M. An epigenetic GPI anchor defect impairs TLR4 signaling in the B cell transdifferentiation model for primary human monocytes BLaER1. Sci Rep. 2021 Jul 22;11(1):14983. doi: 10.1038/s41598-021-94386-z.PMID: 34294787 https://pubmed.ncbi.nlm.nih.gov/34294787/
Herzner AM, Hagmann CA, Goldeck M, Wolter S, Kübler K, Wittmann S, Gramberg T, Andreeva L, Hopfner KP, Mertens C, Zillinger T, Jin T, Xiao TS, Bartok E, Coch C, Ackermann D, Hornung V, Ludwig J, Barchet W, Hartmann G and Schlee M. Sequence-specific activation of cGAS by Y-form DNA structures as found in primary HIV-1 cDNA. Nat Immunol. 2015. 16(10):1025-33
Schuberth-Wagner C, Ludwig J, Bruder AK, Herzner AM, Zillinger T, Goldeck, M, Schmidt T, Schmid-Burgk L, Kerber R, Wolter S, Stümpel JP, Roth A, Bartok E, Drosten C, Coch C, Hornung V, Barchet W, Kümmerer BM, Hartmann G, Schlee M. A conserved histidine in the RNA sensor RIG-I controls immune tolerance to N1-2’O-methylated self RNA. Immunity. 2015. 43(1):41-51
Goubau D*, Schlee M*, Deddouche S, Pruijssers AJ, Zillinger T, Goldeck M, Schuberth C, Van der Veen AG, Fujimura T, Rehwinkel J, Iskarpatyoti JA, Barchet W, Ludwig J, Dermody TS, Hartmann G, Reis e Sousa C. Antiviral immunity via RIG-I-mediated recognition of RNA bearing 5'-diphosphates. Nature. 2014. 514(7522):372-5
Hagmann CA, Herzner AM, Abdullah Z, Zillinger T, Jakobs C, Schuberth C, Coch C, Higgins PG, Wisplinghoff H, Barchet W, Hornung V, Hartmann G, Schlee M. RIG-I detects triphosphorylated RNA of Listeria monocytogenes during infection in non-immune cells. PLoS One. 2013. 8(4): e62872
Abdullah Z*, Schlee M*, Roth S, Mraheil MA, Barchet W, Böttcher J, Hain T, Geiger S, Hayakawa Y, Fritz JH, Civril F, Hopfner K-P, Kurts C, Ruland J, Hartmann G, Chakraborty T and Knolle PA. RIG-I detects infection with live Listeria by sensing secreted bacterial nucleic acids. EMBO J. 2012. 31, 4153 – 4164.
Schlee M, Roth A, Hornung V, Hagmann CA, Wimmenauer V, Barchet W, Coch C, Janke M, Mihailovic A, Wardle G, Juranek S, Kato H, Kawai T, Poeck H, Fitzgerald KA, Takeuchi O, Akira S, Tuschl T, Latz E, Ludwig J, Hartmann G. Recognition of 5' Triphosphate by RIG-I Helicase Requires Short Blunt Double-Stranded RNA as Contained in Panhandle of Negative-Strand Virus. Immunity. 2009; 31(1):25-34
Schlee M, Hölzel M, Bernard M, Mailhammer R, Schuhmacher M, Reschke J, Eick D, Marinkovic D, Wirth T, Rosenwald A, Staudt LM, Eilers M, Baran-Marszak F, Fagard R, Feuillard J, Laux G, Bornkamm GW, c-MYC activation impairs the NF-kB and interferon response: implications for the pathogenesis of Burkitt’s lymphoma, Int J Cancer. 2007; 120(7):1387-95
- Schlee M, Hartmann G. Discriminating self from non-self in nucleic acid sensing. Nat Rev Immunol. 2016 Sep;16(9):566-80.
- Schlee M. Master sensors of pathogenic RNA - RIG-I like receptors. Immunobiology. 2013; 218 (11): 1322-1335
Mitarbeiter*innen
Charlotte Hunkler, TA
Enable JavaScript to view protected content.
Tel.: +49 228 287-51219
Linda Kurth, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51154
Dr. Julia Mahlberg, PostDoc
Enable JavaScript to view protected content.
Tel.: +49 228 287-51154
Heike Prange, BTA
Enable JavaScript to view protected content.
Tel.: +49 228 287-51152
Tamara Schorpp, Doctoral candidate
Enable JavaScript to view protected content.
Tel.: +49 228 287-51154
Christina Wallerath, TA
Enable JavaScript to view protected content.
Tel.: +49 228 287-51216

von vorne (links) nach hinten (rechts): Prof. Dr. Martin Schlee, Julia Wegner, Alexander Kirchhoff, Katrin Ciupka, Heike Prange, Christina Wallerath, Steven Wolter, Agathe Grünewald, Ann Kristin de Regt (nicht abgebildet: Marvin Holz, Adham Mohamed)