Arbeitsgruppe Wilhelm
Wissenschaftlicher Ko-Direktor / Arbeitsgruppenleiter

Prof. Christoph Wilhelm, Ph.D.
Enable JavaScript to view protected content.
Tel.: +49 228 287-51721
Fax: +49 228 287-16094
Zone Nord, Gebäude 12
1. Etage, Raum 1G402
Wir untersuchen die metabolische Kontrolle von Immunzellen im Gewebe, um besser zu verstehen, wie diese bei Infektionen oder chronischen Entzündungen reguliert sind. Insbesondere wollen wir herausfinden, wie sich Ernährung und Fasten auf das Immunsystem auswirken und wie exogene und endogene Stoffwechselprodukte die Immunzellen beeinflussen. Wir konnten bereits zeigen, dass eine ketogene Diät als wirksame diätetische Interventionsstrategie zur Behandlung chronischer Atemwegsentzündungen eingesetzt werden kann oder die Immunantwort bei schweren Atemwegsinfektionen durch die Bereitstellung von Ketonkörper als alternative Kohlenstoffquelle unterstützt. Unser Hauptziel ist es, die metabolischen, ernährungsphysiologischen und physiologischen Folgen einer sich verändernden Umwelt mit zunehmender Industrialisierung auf die schützende Immunität und immunvermittelte Pathologien zu verstehen.
In den letzten Jahrzehnten hat sich die Epidemiologie von Immunkrankheiten in der westlichen Welt erheblich verändert. So geht die allmähliche Ausrottung vieler Infektionskrankheiten mit einer Zunahme chronischer Entzündungen wie Asthma oder chronisch entzündlichen Darmerkrankungen (IBD) einher. Im Mittelpunkt unseres wissenschaftlichen Interesses steht das Verständnis der zugrundeliegenden Mechanismen und Ursachen für die stetig zunehmenden Fälle chronischer Entzündungen. In jüngster Zeit wurde eine Gruppe von angeborenen Immunzellen, die so genannten angeborenen lymphoiden Zellen (ILC), identifiziert, die sich an verschiedenen Barriereoberflächen, wie der Lunge oder dem Darm, befinden. Die Hauptaufgabe der ILC ist der Schutz und die Aufrechterhaltung der Gewebsbarriere, indem sie antibakterielle Reaktionen, die Gewebereparatur oder die Immunität gegen Würmern vermitteln. Neben ihrer Schutzfunktion fördert eine chronische Aktivierung von ILC jedoch auch Entzündungen, und ILC werden mit entzündlichen Erkrankungen wie Allergien, Asthma und IBD in Verbindung gebracht. Im Allgemeinen ist die Ätiologie dieser Barrierekrankheiten nur unzureichend erforscht, aber es wird vermutet, dass die mit der in Industrienationen einhergehenden Veränderungen des Lebensstils, wie z. B. die reichliche Aufnahme von Nahrungsmitteln und die verstärkte Hygiene, die zu einem generellen Fehlen von Parasiteninfektionen führen, eine Rolle bei der Krankheitsentwicklung spielen. Im Gegensatz dazu sind die Menschen in den Entwicklungsländern nach wie vor von Unterernährung und einer erhöhten Infektionsgefahr betroffen, ohne dass jedoch immunvermittelte Krankheiten und chronische Entzündungskrankheiten wie Asthma oder IBD auftreten. Unsere zentrale Hypothese ist, dass chronisch-pathogene Immunantworten durch den westlichen Lebensstil geprägt sind und metabolisch anders reguliert werden als schützende Immunantworten bei Infektionen. Indem wir sowohl schützende Immunreaktionen auf Infektionen als auch chronische Entzündungen untersuchen, werden wir in der Lage sein, die Stoffwechselmechanismen zu beschreiben, die schützende und pathogene Immunreaktionen kontrollieren.
Die metabolische Kontrolle von schützenden oder pathogenen ILC-Reaktionen
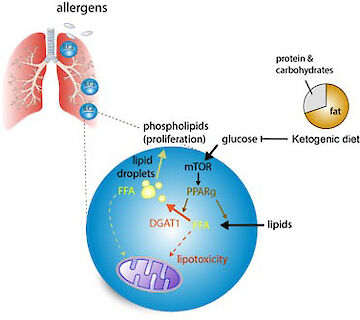
Bei der Untersuchung der Stoffwechselwege, die die schützenden ILC2-Funktionen in Mäusen steuern, entdeckten wir, dass die Antihelminthen-Immunität entscheidend vom Fettsäure-Stoffwechsel abhängt, während Glukose entbehrlich ist (Wilhelm et al. 2016). Diese Ergebnisse deuten darauf hin, dass die schützende ILC2-Reaktion, die auf die Reparatur von Infektionen ausgerichtet ist, durch den katabolen Fettsäure-Stoffwechsel (Fettsäureoxidation) angetrieben wird. Diese Entdeckung bedeutet, dass die ILC2-vermittelte Gewebereparatur und die Anti-Helminthen-Immunität auch bei geringer Glukoseverfügbarkeit und Mangelernährung aufrechterhalten werden können. Sowohl Unterernährung als auch Helmintheninfektionen sind in der westlichen Welt weitgehend unbekannt, mit unbekannten Folgen für die ILC-vermittelten Immunreaktionen. Unsere neueren Arbeiten zeigen nun, dass pathogene ILC2 bei Entzündungen der Atemwege (Asthma) eine erhöhte Aufnahme von Glukose und Lipiden benötigen, die eine starke Vermehrung und Pathogenität fördern. Im Gegensatz zum Stoffwechselprofil der schützenden ILC2 bei Helmintheninfektionen stellten wir fest, dass bei Asthma von außen zugeführte Fettsäuren für anabole Prozesse zum Aufbau von Zellmembranen verwendet werden. Daher spekulierten wir, dass die pathogene Aktivierung von der Verfügbarkeit überschüssiger Nährstoffe abhängen könnte. Wir konnten zeigen, dass eine ketogene Ernährung als wirksame diätetische Interventionsstrategie zur Behandlung von ILC-bedingten Pathologien wie allergischem Asthma (Karagiannis et al. 2020) angewandt werden kann. Da ketogene Diäten einen Zustand des Fastens und des Nährstoffmangels imitieren, könnte dies erklären, wie Perioden von Fasten und verringerter Nahrungsaufnahme die Entwicklung chronischer Entzündungen in der Vergangenheit verhindert haben. Gleichzeitig könnte dieser Umstand das vermehrte Auftreten von Immunpathologien in der westlichen Welt durch den erhöhten Konsum von Kohlenhydraten und Fetten erklären. Als Folgemaßnahme zu unseren veröffentlichten Studien wollen wir die Bedeutung des Lipidstoffwechsels für die Biologie der ILC und die positiven Auswirkungen einer verringerten Nahrungsaufnahme, des Fastenstoffwechsels und der Ketogenese bei der Aktivierung von Immunzellen besser verstehen.
Project related publications:
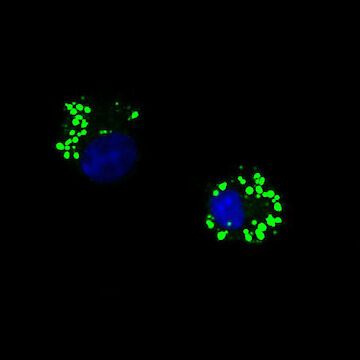
Karagiannis F, Kharabi Masouleh S, Wunderling K, Surendar J, Schmitt V, Kazakov A, Michla M, Hölzel M, Thiele C & Wilhelm C. Lipid droplet formation drives pathogenic type 2 innate lymphoid cells in airway inflammation. Immunity 2020; 52(4):620-634.
Wilhelm C, Harrison OJ, Pelletier M, Spencer SP, Urban JF Jr, Ploch M, Ramalingam TR, Siegel R, Belkaid Y. Critical role of fatty acid metabolism in ILC2 mediated barrier protection during malnutrition and helminth infection. J Exp Med 2016: 213(8):1409-18.
Fasten während Infektionen und die Funktion von Ketonkörpern, Ketogenese und Ketogener Diät
In diesem Projekt wollen wir die positiven Auswirkungen einer Nährstoffrestriktion bei Infektionen besser verstehen. Während sowohl Tiere als auch Menschen, die mit Influenza infiziert sind, eine robuste Ketogenese entwickeln, ist diese Reaktion bei Patienten, die mit Sars-CoV2 infiziert sind, nicht vorhanden (Karagiannis et al. Nature 2022). Unsere veröffentlichte Arbeit zeigt, dass aus der Leber stammende Ketonkörper (Beta-Hydroxybyturat), das im Zusammenhang mit infektionsbedingter Anorexie und Ketogenese produziert wird, die antivirale T-Zell-Immunität verstärkt. Im Anschluss an unsere veröffentlichte Studie untersuchen wir die positive Wirkung der Ketogenese und die Produktion von BHB weiter, aber auch, wie die infektionsinduzierte Ketogenese reguliert wird. In diesem Projekt verfolgen wir die Idee, dass Ketonkörper, die im Rahmen einer infektionsbedingten Anorexie aus Lipiden gebildet werden, direkt eine schädigende Aktivierung von Immunzellen verhindern und gleichzeitig eine schützende Immunität fördern können.
COVID-19
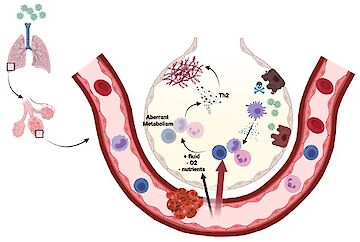
Ketone bodies in COVID-19
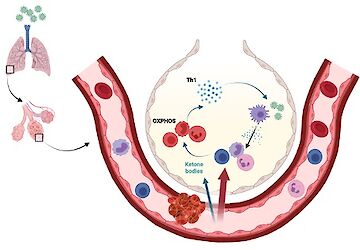
Project related publications:
Karagiannis F, Peukert K, Surace L, Michla M, Nikolka F, Fox M, Weiss P, Feuerborn C, Maier P, Schulz S, Al B, Seeliger B, Welte T, David S, Grondman I, de Nooijer AH, Pickkers P, Kleiner JL, Berger MM, Brenner T, Putensen C; Bonn COVIMMUNE Consortium, Kato H, Garbi N, Netea MG, Hiller K, Placek K, Bode C, Wilhelm C. Impaired ketogenesis ties metabolism to T cell dysfunction in COVID-19. Nature 2022; 609(7928):801-807
Wilhelm C, Surendar J, Karagiannis F. Enemy or ally? Fasting as an essential regulator of Immune resposnes. Trends in Immunology 2021; 42(5):389-400.
Neue Therapien mit Stoffwechselprodukten des Darms?
Korrelationsstudien und experimentelle Belege deuten darauf hin, dass zunehmende Hygiene und Verwestlichung chronische Entzündungszustände fördern. Virusinfektionen der Atemwege führen zu einem vorübergehenden Zustand des Fastens und der Ketogenese. Darüber hinaus führen Helmintheninfektionen zu Veränderungen des Wirtsstoffwechsels, die möglicherweise darauf zurückzuführen sind, dass die Parasiten einen ausreichenden Zugang zu Nährstoffen benötigen. Hierdurch kann es zu einem direkten Wettbewerb der Würmer mit dem Wirt und der Mikrobiota kommen, was zu einer Veränderung einer Vielzahl von Stoffwechselprodukten führen kann. Um die Auswirkungen einer verstärkten Hygiene zu verstehen, gehen wir von der Hypothese aus, dass Wurminfektionen die pathogene Aktivierung von Immunzellen und die Entwicklung einer chronischen Entzündung verhindern, indem sie den Stoffwechsel des Wirts einschränken. In diesem Zusammenhang untersuchen wir die immunmodulatorische Kapazität von Metaboliten, die direkt aus der Nahrung stammen oder vom Wirt oder intestinalen Mikrobiota gebildet werden. Hierbei wollen wir verstehen wie diese Stoffwechselprodukte die schützende Immunantwort bei Infektionen beeinflussen und ihre Funktion bei immunvermittelten Pathologien bei Mäusen untersuchen.
Mitarbeiter*innen
Dr. David Fernando Colón Morelo, PostDoc
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Maria Dovermann, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Dr. Fotis Karagiannis, PostDoc/Projektleiter
Enable JavaScript to view protected content.
Tel.: +49 228 287-51730
Mario Lauterbach, Core Facility Leiter
Enable JavaScript to view protected content.
Tel.: -
Dr. Timothy McCulloch, PostDoc
Enable JavaScript to view protected content.
Tel.: +49 228 287-51730
Roman Rombo, Technischer Assistent
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Laetitia Sanelli, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Carola Sarici, Technische Assistentin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51730
Dhruvi P. Shah, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Jonathan Scheler, WHF
Tel.: +49 228 287-51720
Maria Rafailia Theodorou, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Patricia Weiss, Technische Assistentin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51730
Chantal Wientjens, Doktorandin
Enable JavaScript to view protected content.
Tel.: +49 228 287-51720
Aktuelle Stellenangebote der AG Wilhelm
- PhD position (m/f/d)
- Postdoc positions Wilhelm Lab (m/f/d) (100%)
- Master's Thesis Opportunity in Immunometabolism
Wir sind immer daran interessiert, hochmotivierte Student*innen und Postdocs zu rekrutieren und freuen uns jederzeit über Bewerbung von potentiellen Kandidat*innen (m/w/d).