Peptidrezeptorradiotherapie (PRRT) bei neuroendokrinen Tumoren (NET)
Liebe Patientin, lieber Patient,
die Klinik für Nuklearmedizin, Universitätsklinikum Bonn, verwendet schon mehr als 10 Jahre radioaktiv markierte Eiweiße zur Diagnostik und Therapie der neuroendokrinen Tumore (NET).
Neuroendokrine Tumore sind eine seltene Klasse von Krebserkrankungen (Neoplasien), die aus hormonbildenden Zellen entstehen und die Eigenschaft haben, spezielle Hormone zu produzieren und freizusetzen, die erhebliche klinische Symptome hervorrufen können. Die meist zunächst unbemerkt und langsam wachsenden NETs werden häufig erst in einem fortgeschrittenen Stadium diagnostiziert. Oft finden sich zum Zeitpunkt der Diagnosestellung daher bereits Metastasen in der Leber.
Gut differenzierte neuroendokrine Neoplasien (NEN) zeigen eine übermäßige Anzahl der Somatostatinrezeptoren (SSTRs) auf ihrer Oberfläche, insbesondere des SSTR-2-Subtyps. So sind SSTRs therapeutische und diagnostische (theranostische) Ziele in NEN. Seit fast drei Jahrzehnten sind diese bekannt und haben sich inzwischen gut als Zielstrukturen etabliert.
Die Hauptsäulen der Therapien bei GEP-NET- Erkrankungen sind Chirurgie, Biotherapie mit Somatostatin-Analoga (SSA), Peptidrezeptor-Radionuklid-Therapie (PRRT) mittels 177Lu-DOTATATE ( LUTATHERA® ), molekular gezielte Therapien wie Everolimus, Chemotherapie und lokale Ablativtherapie. Die Komplexität des NET erfordert eine enge Zusammenarbeit innerhalb eines interdisziplinären Teams. Daher empfiehlt es sich, Patienten in spezialisierten Zentren zu behandeln, in denen Spezialisten aus den Fachrichtungen Pathologie, Radiologie, Onkologie, Gastroenterologie, Onkologische, Chirurgie, und Nuklearmedizin zusammenarbeiten. Nur so können die Richtlinien an die klinische Praxis angepasst werden, wobei ein Austausch von aktuellem Wissen interdisziplinär erfolgt. So kann ein individueller Therapieansatz für jeden Patienten entwickelt werden.
LUTATHERA®
Effektive Therapie mit einem klinisch relevanten progressionsfreien Überleben (PFS) von 28,4 Monaten in der Zulassungsstudie NETTER-11
Breite Zulassung für G1/G2 GEP-NET (insbesondere Midgut- und Pankreas-NET)
Standardisierte, evidenzbasierte Therapie mit einem Fertigarzneimittel1
1.Aktuelle LUTATHERA Fachinformationen.




Lutathera 370 MBq/ml Infusionslösung Wirkstoff: Lutetium (177Lu) -Oxodotreotid.
Zusammensetzung: 1 ml Lsg. Enthält am Tag und zum Zeitpkt. Der Kalibrierung 370 MBq Lutetium (177Lu) -Oxodotreotid.
Sonstige Bestandteile: Essigsäure, Natriumacetat, Gentisinsäure, Ascorbinsäure, Pentetsäure, Natriumchlorid, Natriumhydroxid, Wasser für injektionszw.
Anwendungsgebiet: Lutathera ist zur Behandl. von nicht resezierbaren oder metastatischen, progressiven, gut differenzierten (G1 und G2) Somatostatinrezeptorpositiven gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NETs) bei Erwachsenen indiziert.
Gegenanzeigen: Überempfindlichk. Gg. Den Wirkstoff oder einen der sonst. Bestandt.; bestehende oder vermutete Schwangerschaft, oder wenn eine Schwangerschaft nicht ausgeschlossen werden kann; Nierenversagen mit einer Kreatinin-Clearance <30 ml/min. Bei Patienten mit stark beeinträchtigter hämatologischer Funktion vor Therapiebeginn bzw. während der Behandlung wird keine Behandlung empfohlen, es sei denn, es liegt ausschließlich eine Lymphozytopenie vor.
Nebenwirkungen: Sehr häufig: Thrombozytopenie,Lymphopenie, Anämie, Panzytopenie, vermind. Appetit, Übelkeit, Erbrechen, Müdigkeit; Häufig: Myelodysplastisches Syndrom, Leukopenie, Neutropenie, sekund. Hypothyreose, Hyperglykämie, Dehydrierung, Hypomagnesiämie, Hyponatriämie, Schlafstöhrung, Schwindel, Dysgeusie, Kopfschmerzen, Lethargie, Synkope, QT-Verl. im EKG, Hypertonie, Erröten, Hitzewallungen, Hypotonie, Dyspnoe, abdom. Völlegrfühl, Diarrhö, abdom. Schmerzen, Verstopfung, Oberbauchschmerzen, Dyspepsie, Gastrites, Hyperbilirubinämie, Alopezie, muskuloskelettale Schmerzen, Muskelspasmen, akute Nierenschädigung, Hämaturie, Nierenversagen, Proteinurie, Reaktion an d. Injektionsstelle, peripheres Ödem, Schmerzen am Verabreichungsort, Schüttelfrost, grippeähnliche Erkrank., erh. Blutkreatinin, erh. GGT, erh. ALT, erh. AST, erh. Blut-ALP, Transfusion; Gelegentl.: Konjunktivitis, Infekt. der Athemwege, Zystitis, Pneumonie, Herpes zoster, opthal. Herpes zoster, Grippe, Staphylokokken-Infekt., Streptokokken-Bakteriämie, akute myloische Leukämie, akute Leukämie, chron. Myelomonozytäre Leukämie, refraktäre Zytopenie mit unilineärer Dysplasie, nephrogene Anämie, Knochenmarksinsuffizienz, thrombozytopenische Purpura, Hypersensitivität, Hypothyreose, Diabetes mellitus, karzinoide Krise, Hyperparathyreose, Hypernatriämie, Hypophosphatämie, Tumorlyse-Syndrom, Hyperkalzämie, hypokalzämie, Hypalbuminämie, metab. Azidose, Angstzustände, Halluzinationen, Desorientierung, Ameisenlaufen, hepat. Enzephalophatie, Parästhesie, Parosmie, Schläfrigk., spirale Nervenkompression, Augenerkrank., Schwindel, Vorhofflimmern, Palpitationen, Myokardinfarkt, Angina pectoris, kardiog. Schock, Vasodilatation, peripheres Kältegefühl, Blässe, orthostatische Hypotonie, Phlebitis, oropharyngeale Schmerzen, Pleuraerguss, vermehrt. Sputum, Engegefühl im Hals, Mundtrockenheit, Flatulenz, Aszites, gastrointestinale Schmerzen, Stomatitis, Hämatochezie, abdom. Unwohlsein, intestinale Obstruktion, Colitis, akute Pankreatitis, rektale Blutung, Meläna, Unterbauchschmerzen, Hämatemesis, hämorrhagischer Aszitis, lleus, vermind. Pankreasenzyme, hepatozelluläre Schädigung, Cholestase, hepat. Kongestion, Leberversagen, Hautausschlag, trock. Haut, Schwellung i. Gesicht, Hyperhidrose, generalisierter Pruritus, Leukozyturie, Harninkontinenz, vermin. GFR, Nierenstöhrung, akute prärenale Insuffizienz, Niereninsuffizienz, Schwellung an d. Injektionsstelle, Unwohlsein i. Brustkorb, Brustschmerzen, Pyrexie, Malaise, Schmerzen, Tod, Wahrnehmensstöhrung, vermind. Kaliumwerte i. Blut, erh. Harnstoff i. Blut, erh. Glykosyliertes Hämoglobin, vermind. Hämatokrit, Protein i. Urin, Gewichtsverl.,erh. Kreatinin-Phosphokinase i. Blut, erh. Laktat-Dehydrogenase i. Blut, Blutkatecholamine, erh. C-reaktives Protein, Fraktur des Schlüsselbeins, Bauchhöhlendrainage, Dialyse, Einlage e. gastrointestinalen Sonde, Stenteinlage, Abzessdrainage, Knochenmarksgewinnung, Polypektomie, phys. Behind.; Nicht bekannt: Angioödem.
Warnhinweis: Radioaktives Arzneimittel. Verschreibungspflichtig.
Weitere Informationen siehe Fachinformation Pharm. Untern.: Advanced Accelerator Applications, 8-10 Rue Henri Sainte-Claire Deville, 92500 Rueil-Malmaison, Frankreich.
Quelle: Novartis Radiopharmaceuticals GmbH, Roonstraße 25, 90429 Nürnberg, Deutschland. Stand April 2023
Die 177Lu-DOTATATE- Moleküle lagern sich an die Somatostatinrezeptoren der erkrankten Zellen an, wie ein Schlüssel, der das passende Schloss erkennt. Aufgrund der spezifischen Bindung („Schlüssel-Schloss-Prinzip“) reichert sich Radioaktivität im Tumorgewebe an und bestrahlt dieses von innen. Durch die Kopplung des Radionuklides an ein Peptidmolekül, welches spezifisch an das Zielgewebe (Tumorläsionen) bindet, können sehr hohe – und sonst nicht mögliche – Strahlendosen hoch- spezifisch und unter größtmöglicher Schonung des gesunden Gewebes direkt am Tumor appliziert werden. Das Lutetium-177 hat nicht nur therapeutisch wirksame ß-Strahlen (effektive Reichweite im Gewebe von 1 mm), sondern auch diagnostisch verwertbare Strahlen (Gamma-Strahlung), die zur Bildgebung nach der Verabreichung des Therapiepräparats verwendet wird.
Zuerst sollte eine ausreichende Speicherung von Somatostatin-Analoga in den Tumorläsionen nachgewiesen sein. Dies kann durch ein Rezeptor- PET/CT wie z.B. das 68Ga-DOTATOC PET/CT erfolgen (Abbildung 1).
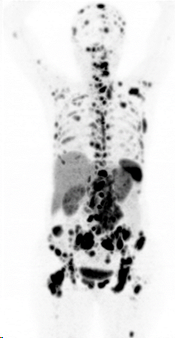
Abbildung 1: 68Ga-DOTATOC PET zeigt mehrere Knochen- und Lymphknotenmetastasen
Die 177Lu-DOTATATE-Therapie erfolgt auf der Station Winkler, der Nuklearmedizinischen Therapiestation am Uniklinikum Bonn. Zuerst erfolgt eine gründliche Untersuchung durch unsere Stationsärzte. Blutbild und Tumormarker werden bestimmt. Vor dem ersten Zyklus wird auch eine Nierenszintigraphie zum Ausschluss einer obstruktiven Harnabflussstörung durchgeführt. Etwa 30 Minuten vor der Applikation der radioaktiven Substanz wird zum Schutze der Nieren vor übermäßiger Bestrahlung eine mehrstündige Infusion bestimmter Aminosäuren, welche die unerwünschte Nieren-Speicherung des Therapiepräparates reduziert, verabreicht; diese Infusion kann eine vorübergehende Übelkeit verursachen. Das Therapiepräparat wird intravenös als Infusion über 20 Minuten gegeben.
Nach der Therapiegabe müssen Sie 48 Stunden auf der Station bleiben. Sie können persönliche Gegenstände, wie Bücher, PC, Tablets, Handy, Kleidung, etc. mitbringen und auch wieder nach Hause mitnehmen. Im Zimmer haben Sie einen persönlichen Flachbildschirm am Bett. Am Tag nach der Therapie werden Ganzkörperaufnahmen durchgeführt, um die Verteilung des Therapiepräparats im Körper zu überprüfen (Abbildung 2).
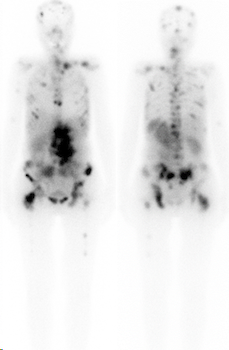
Abbildung 2: 177Lu-DOTATATE Aufnahme 24 Std. nach der Applikation der Therapiesubstanz
Die 177Lu-DOTATATE-Therapie wird in mehreren Zyklen durchgeführt. In der Regel werden zunächst 4 Zyklen geplant. Die Therapiezyklen erfolgen alle 8-12 Wochen.
Bei einem erneuten Progress der Erkrankung können weitere Zyklen der Therapie erfolgen.
Eine relevante Strahlenbelastung durch die Injektion der radiomarkierten Substanz ist für das Knochenmark, und die Niere beschrieben. Diese führte nach bisherigen Beobachtungen jedoch zu keiner relevanten Organ- Fehlfunktion oder –Beeinträchtigung. Wesentliche Einschränkungen der Nierenfunktion, eine persistierende Knochenmarksinsuffizienz oder anderweitigen Ausfälle sind also unwahrscheinlich. Als seltene Ausnahme wurde eine Knochenmarksinsuffizienz beschrieben, siehe hierzu auch den Passus zum MDS (myelodysplastisches Syndrom). Insgesamt wurden die Therapiezyklen gut vertragen. Übelkeit (selten mit Erbrechen) in den ersten 24 Stunden nach Therapie wurden in maximal 30% der Fälle beobachtet. Eine vorübergehende milde Knochenmarksdepression (mit vorübergehender Leuko- oder Thrombopenie) ist die häufigste Nebenwirkung bei etwa einem Viertel der Fälle; diese erfordert in aller Regel keinerlei zusätzlichen Maßnahmen oder Therapien. Eine mögliche Spätfolge kann aber das Auftreten eines MDS mit Knochenmarksinsuffizienz sein. Diese tritt nach aktueller Datenlage in ca. 0,5% der Fälle (d.h. 1 von 200 therapierten Patienten) auf.
Die Entscheidung zur 177Lu-DOTATATE-Therapie treffen Sie zusammen mit Ihrem Onkologen/Gastroenterologen und den Experten aus unserer Abteilung. Nach der „Machbarkeitsprüfung“ einer 177Lu-DOTATATE-Therapie wird Ihr individueller Fall in unserer Tumorkonferenz für die neuroendokrinen Tumoren vorgestellt. Dieser Schritt entfällt bei Vorhandensein eines auswärtigen Tumorkonferenzbeschlusses.
Direktor der Klinik für Nuklearmedizin
Prof. Dr. med. Markus Essler
Enable JavaScript to view protected content.
Therapiesekretariat
Frau Oregan Vautey
Tel.: +49 228 287-16171
Fax: +49 228 287-19057
Enable JavaScript to view protected content.
Station Winkler
Tel.: +49 228 287-16855
Fax: +49 228 287-19107